🧪 실험 목표
산화 환원 적정법 중 아이오딘 적정법으로 시판되는 비타민C 음료에서 아스코르브산의 함량을 측정할 수 있다.
🧪 실험 이론
✔ 비타민C의 환원성
괴혈병은 비타민C, 즉 아스코르브산 결핍증으로 전신 피로감, 하품, 호흡곤한, 두통, 메스꺼움, 변비, 우울증, 식욕감퇴, 잦은 혈관 출혈, 잇몸 출혈, 월경 불순, 뼈나 관절을 통증이나 출혈, 창백증 빈혈, 뼈의 연화 등의 증상을 보인다. 비타민C의 화학적 성질을 살펴보면 아스코르브산(L-ascorbic acid)은 디히드로아스코르브산(dehydro-L-ascorbic acid)으로 쉽게 산화된다. 이 변환은 가역적 산화, 환원반응이므로 비타민C는 산화되면서 다른 물질을 환원 시키는 환원제로 작용할 수 있는 물질이다.
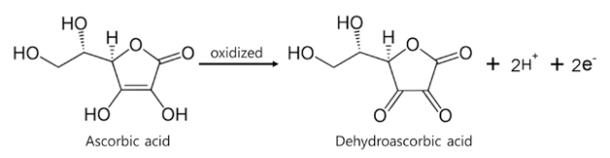
비타민C는 동물의 콜라겐(collagen)을 합성하는데 필수적이다. 비타민C가 부족하면 콜라겐 합성 과정이 차단되어 괴혈병의 전형적 증상인 출혈, 감염 및 뼈의 연화 등이 나타난다. 콜라겐을 합성하는 효소는 2가철이온(Fe2+)과 느슨하게 결합하고 있어야 활성이 있고, 철분이 산화되어 3가철이온(Fe3+)으로 변하면 활성이 없어진다. 아스코르브산(ascorbic acid)은 Fe3+를 Fe2+로 환원시켜 주며 효소의 주요 부분인 –SH기를 환원 상태로 유지시켜 주는 기능이 있기 때문에 콜라겐 합성을 도와줄 수 있으며, 이외에도 산화-환원 반응이 개입된 중요한 생명 현장이 있다면 비타민C가 필요하다는 것을 예상할 수 있다.
✔ 아스코르브산의 아이오딘 적정
아이오딘 분자(I2)는 물에 약간만 녹지만(20℃에서 1.33×10-3M), 아이오딘화 이온(I-)과 삼아 아이오딘화 이온(I3-)을 형성하면 용해도가 크게 증가한다.

이번 실험에서는 비타민C를 과량의 아이오딘화칼륨(KI) 존재 하에 표준물질 아이오딘산칼륨(KIO3)으로 적정한다. 이 과정에서 먼저 아이오딘산 이온(IO3-)은 아이오딘화 이온(I-)을 산화시켜 아이오딘(I2)를 만들고, 이 I2에 의해 비타민 C가 산화된다.


전체 반응은 다음과 같다.

지시약으로는 녹말 용액을 사용하여 비타민C와 반응하고 남은 아이오딘 녹말과 반응하여 색을 띄게 함으로써 종말점을 찾는다.
🧪 실험 준비물
아이오딘화칼륨(KI), 아이오딘산칼륨(KIO3), 비타민C 음료, 3 M 황산(H2SO4), 가용성 녹말, 250 mL 부피플라스크, 50 mL 뷰렛, 10 mL와 20 mL부피 피펫, 깔때기, 100 mL 삼각플라스크, 100 mL 비커, 1000 mL 비커, 유리막대, 씻기병, 자석 교반기, 화학 저울, 약수저 4개, 알콜램프와 삼발이, 스탠드와 뷰클램프
📌 유의사항
• 녹말 지시약을 만들 때 가용성 녹말은 반드시 찬물에 넣어야 잘 풀어지고, 충분히 끓여야 투명해져서 맑고 투명한 지사약을 얻을 수 있다.
• 아이오딘 용액이 피부에 묻으면 오랫동안 피부색이 변하게 되므로 주의한다.
🧪 실험 방법
1. 1% 녹말 지시약 준비
가. 100 mL 비커에 녹말 0.5 g과 증류수 50 mL를 넣고 유리 막대로 저어서 녹말을 충분히 푼다.
나. 알코올 램프로 가열하면서 용액이 끓어서 투명해지면 불을 끄고 상온으로 식힌다.


2. 아이오딘 표준 용액 준비
가. KI 3 g을 측정하고, KIO3 0.150 g을 1 mg단위까지 정확히 측정하여 100 mL 비커에서 소량의 증류수로 녹인다.
나. 과정(가)의 녹인 용액을 250 mL 부피플라스크에 넣고, 씻기병을 이용하여 비커를 증류수로 헹구어 부피 플라스크에
붓는다.
다. 부피 피펫으로 3 M H2SO4 10 mL를 과정(나)의 부피 플라스크에 넣는다. 이때 부피 플라스크의 색 변화를 주의 깊게
관찰한다.
라. 증류수로 250 mL 표선까지 채우고 뚜껑을 닫아 뒤집어 가며 잘 섞는다.


3. 아스코르브산 요액의 아이오딘 적정
가.비타민C 음료 10 mL를 100 mL 부피플라스크에 넣고 표선까지 증류수를 채운다.
나. 묽힌 비타민C 용액 20 mL를 100 mL 삼각플라스크에 취한 뒤 1% 녹말 용액 10방울 정도 넣는다.
다. 2개의 삼각플라스크를 더 준비해 적정할 용액 3개를 준비한다.
라. 뷰렛을 스탠드에 매달고 콕은 잠금채로 KIO3 표준 용액을 100 mL 비커에 옮겨 깔때기를 이용해 붓고 폐수용 비커를 아래에
두고 콕을 열어 용액이 모두 흘러내리게 한다.
마. 뷰렛의 콕을 다시 잠그고 깔때기를 이용해 제조한 KIO3 표준 용액을 채우고, 콕을 잠시 열어 콕 아랫부분의 공기를 제거한
후 시작 눈금을 읽는다.
바. 상온에서 자석 교반기를 이용해 저으면서 적정하며 수용액이 청남색을 20초 정도 유지하면 적정을 멈추고 뷰렛의 나중
눈금을 읽는다.
사. 필요하면 깔때기를 이용해 뷰렛에 KIO3 표준용액을 채우고 적정을 2회 더 반복한다.


🧪 실험 결과 및 분석
| 실 험 | 1회 | 2회 | 3회 |
| IO3- 표준 용액의 농도(M) | 0.15 g ÷ 214.001 g/mol ÷ 0.25 L = 2.8×10-3 M | ||
| IO3- 표준 용액의 처음 눈금(mL) | 8.5 | 16 | 24 |
| IO3- 표준 용액의 나중 눈금(mL) | 0 | 8.5 | 16 |
| 소비된 IO3- 표준 용액의 부피(mL) | 8.5 | 7.5 | 8 |
| 소비된 IO3-의 표준 용액의 평균 부피(mL) | 8.0 mL | ||
| 소비된 IO3-의 평균 몰수(mol) | 2.8×10-3 M ×8.0 mL = 2.24×10-5 mol |
||
📌 아스코르브산 분자량은 176으로 IO3-와 반응한 적정 결과로부터 비타민C 음료(100mL)에 포함된 아스코르브산의 질량을 계산하시오.
아스코르브 산과 IO3-는 3 : 1 로 반응하므로
3 : 1 = Ascorbic acid : 2.24×10-5 mol
Ascorbic acid = 6.72×10-5 mol × 176 g/mol = 1.183×10-2 g(10배 묽힌 용액 20 mL 속 질량)
(20 mL × 5 × 10배 = 100 mL음료)이므로
= 1.183×10-2 g × 50 = 0.5915 g = 591.5 mg 이다.
📌 비타민C 음료 100 mL 속에는 아스코르브산 500 mg이 포함되어 있다. 실험 결과의 오차를 구하시오.
│ (591.5 mg -500 mg) ÷ 500 mg │× 100 = 18.3 %
'Chemistry' 카테고리의 다른 글
| 윌슨의 안개상자 실험(with 방사선 관찰) (0) | 2023.05.23 |
|---|---|
| 식용유를 이용한 바이오 디젤 합성 실험 (0) | 2023.04.11 |
| 음료 속 카페인 추출 및 확인 (0) | 2022.10.13 |
| 농도에 따른 화학 반응 속도 측정 실험 (0) | 2022.05.31 |
| 온도에 따른 화학 반응 속도 측정 실험 (0) | 2022.05.31 |



