📚 화학Ⅰ / Ⅳ. 역동적인 화학반응 / 6. 화학반응과 열의 출입
[12화학Ⅰ 04-06] 화학반응에서 열의 출입을 측정하는 실험을 수행할 수 있다.
📚 화학Ⅱ / Ⅱ. 반응 엔탈피와 화학 평형 / 1. 화학반응과 열의 출입
[12화학Ⅱ02-01] 열화학 반응식을 엔탈피를 이용하여 표현할 수 있다
화학반응에서 열의 출입 측정하기 실험편 https://ssati.tistory.com/22
반응열과 엔탈피
※ 반응열
· 화학반응이 일어날 때 방출하거나 흡수하는 열
· 화학반응이 일어나면 반응물과 생성물이 가지고 있는 에너지가 다르므로 항상 에너지 출입이 따름
※ 엔탈피(H)
· 일정한 압력에서 어떤 물질이 가지고 있는 고유한 총 에너지 함량
→ 어떤 물질이 일정한 압력 하에서 생성되는 동안 그 물질에 축적된 에너지
예) 25℃, 1atm에서 물(H2O) 1 mol이 지닌 엔탈피는
- 수소 원자와 산소 원자가 형성될 때 에너지
- 물 분자를 형성할 때 화학 결합과 관련된 에너지
- 물 분자의 운동 에너지(병진, 진동, 회전) ···
※ 엔탈피 변화(∆H)
· 화학반응이 일어나면 물질의 종류와 상태, 엔탈피가 달라지므로 반응물과 생성물의 엔탈피 차이에 해당하는 열이 출입
→ 화학반응에서의 열의 흐름은 생성물의 엔탈피와 반응물의 엔탈피 차이와 정확히 일치
· 어떤 물질에 포함된 엔탈피(H)는 정확하게 측정할 수 없으나, 화학반응이 진행되는 동아 출입하는 반응열을 측정하면 엔탈피 변화(∆H)를 알 수 있음
→ 엔탈피 변화 = 반응 엔탈피(반응열)
· 화학반응이 일어나면 에너지를 방출하거나 흡수하는데, 엔탈피 변화(∆H)는 생성물의 엔탈피 합에서 반응물의 엔탈피 합을 뺀 값으로 나타냄
∆H = 생성물의 엔탈피 합 - 반응물의 엔탈피 합 = ∑H생성물 - ∑H반응물
· 상태 함수, 즉 경로에는 무관하게 일정한 값을 가짐
· 표준 엔탈피(standard enthalpy), ∆H° : 25℃, 1 atm에서의 엔탈피
※ 발열 반응과 흡열 반응
· 발열반응(exothermic reaction) ( Q > 0 )
- 반응물의 엔탈피 합이 생성물의 엔탈피 합보다 커서 반응이 일어날 때 엔탈피 차이에 해당하는 열을 방출하는 반응
- 엔탈피 변화(∆H)가 0보다 작은 반응으로, 발열반응이 일어나면 주위의 온도가 높아진다.
→ H반응물 > H생성물 ∴ ∆H < 0
예) C(g) + O2(g) → CO2(g), ∆H = -393.5 kJ

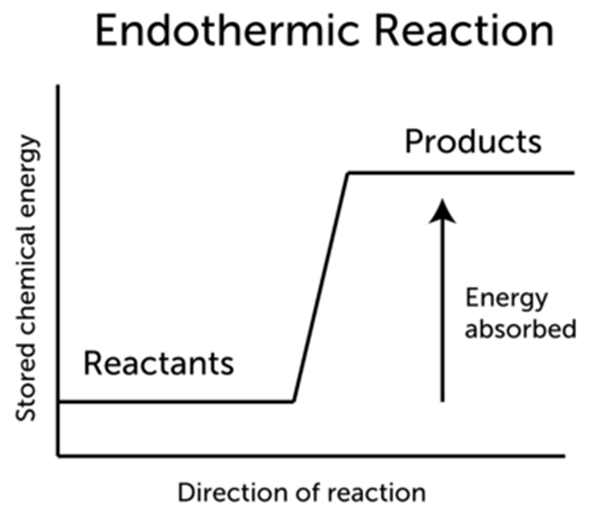
· 흡열 반응(endothermic reactiob) ( Q < 0 )
- 반응물의 엔탈피 합이 생성물의 엔탈피 합보다 작아서 반응이 일어날 때 엔탈피 차이에 해당하는 열을 흡수하는 반응
- 엔탈피 변화(∆H)가 0보다 큰 반응으로, 흡열 반응이 일어나면 주위의 온도가 낮아진다.
→ H반응물 < H생성물 ∴ ∆H > 0
예) N2(g) + O2(g) → 2NO(g), ∆H = 180.6 kJ
반응열의 측정
※ 열용량(C)과 비열(c)
· 열용량 : 물질의 온도를 1℃ 높이는데 필요한 열량, 단위 J/℃
→ 물질의 종류와 양에 따라 달라지며, 열용량이 클수록 물질 온도를 높이는데 필요한 열량이 크다.
· 비열 : 물질 1g의 온도를 1℃ 높이는데 필요한 열량, 단위 J/g·℃
열용량(C) = 비열(c) × 질량(m)
C = c × m
· 어떤 물질이 방출하거나 흡수하는 총열량은 그 물질의 열용량에 온도 변화를 곱하거나, 그 물질의 비열에 질량과 온도 변화를 곱하여 구할 수 있음
열량(Q) = 열용량(C) × 온도 변화(∆t) = 비열(c) × 질량(m) × 온도 변화(∆t)
Q = C × ∆t = c × m × ∆t
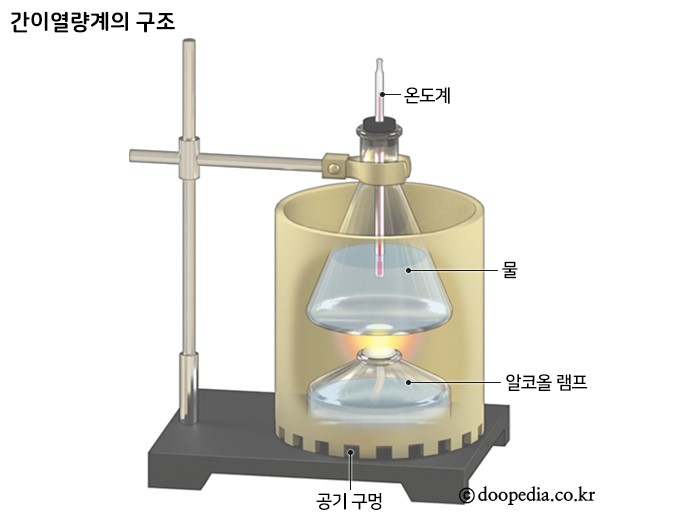
※ 간이 열량계를 이용한 반응열 측정
· 발생한 열량은 열량계 속의 물이 모두 흡수한다고 가정하여 측정한다.
발생한 열량(Q) = 물이 흡수한 열량 = c몰 × m몰 × ∆t몰
· 반응열을 간단하게 측정할 수 있으나 반응열의 일부가 열량계 등 실험 기구의 온도를 변화시키는데 쓰이거나, 열량계 밖으로 빠져나가는 등 열손실이 많으므로 정확한 반응열을 측정하기 어렵다.
· 간이 열량계, 커피컵 열량계, 스티로폼 열량계 : 일정 압력(대기압) 하에서 열량(qp)측정
반응열(Q) = 열량계의 물이 얻은 열량
= 물의 질량(m) × 물의 비열(c) × 온도 변화(∆t)
qsoln = -qrxn
qrxn < 0 : 발열반응
→ 일정한 압력 하에서 계에 의해 얻거나 잃은 열량을 엔탈피라 함
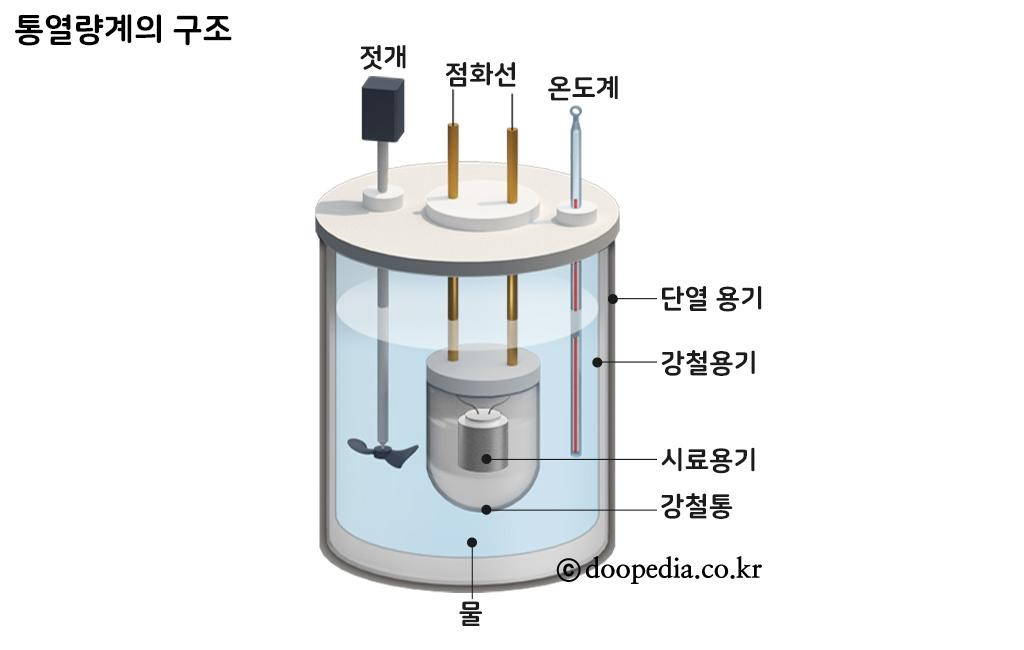
※ 통 열량계를 이용한 반응열 측정
· 발생한 열량은 열량계 속의 물과 통 열량계가 흡수한다고 가정하고 측정한다.
발생한 열량(Q) = 물이 흡수한 열량 + 통열량계가 흡수한 열량
= (c물 × m물 × ∆t) + (C통열량계 × ∆t)
= 전체 열용량(Ccal) × 온도변화(∆t)
qrxn = - Ccal × ∆t
· 통 열량계에서는 열량계 안과 밖 사이에 열의 출입이 거의 없으므로 주위로 빠져나가는 열량이 거의 없으므로 실제 반응열과 비슷한 값을 측정할 수 있다.
헤스의 법칙
※ 헤스 법칙
· 화학반응이 일어나는 동안에 방출하거나 흡수하는 열량은 반응의 처음과 나중 물질의 종류와 상태가 같으면 반응 경로와 관계없이 항상 일정하다.
예) 탄소의 연소 반응
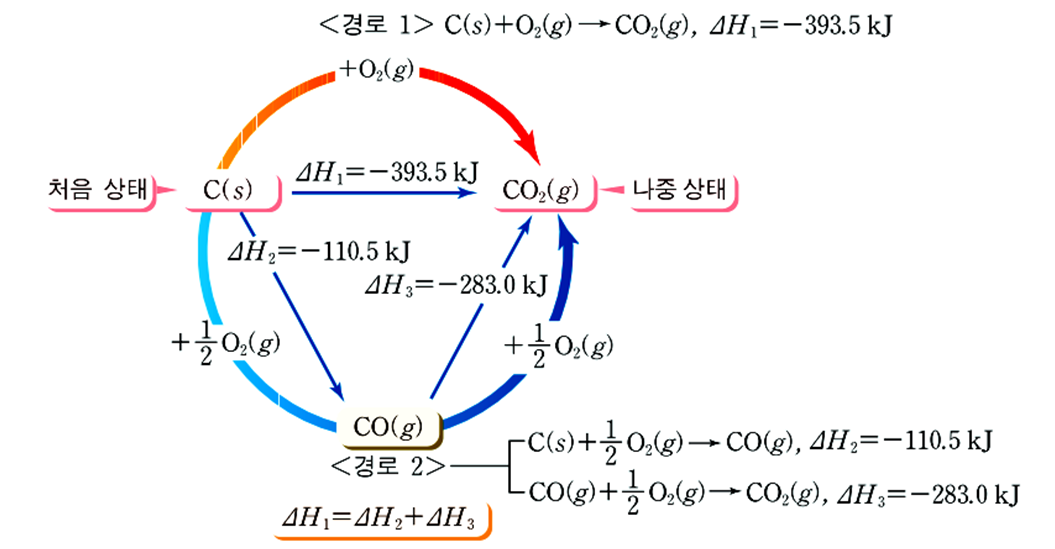
· 경로Ⅰ : 탄소가 연소하여 직접 이산화탄소로 되는 과정
C(s) + O2(g) → CO2(g), ∆H1 = -393.5kJ
· 경로Ⅱ : 탄소가 연소하여 일산화탄소로 되었다가 이산화탄소로 되는 과정
C(s) + ½O2(g) → CO(g), ∆H2 = -110.5kJ
CO(s) + ½O2(g) → CO2(g), ∆H3 = -283.0kJ
· 경로Ⅱ의 반응열의 합은 ∆H2 + ∆H3 = (-110.5) + (-283.0) = -393.5kJ로 경로 Ⅰ의 반응열 ∆H1 = -393.5kJ과 같다.
따라서 처음과 나중 물질의 종류와 상태가 같으면 화학반응의 경로와 관계없이 출입하는 열량은 같다.
C(s) + ½O2(g) → CO(g), ∆H2 = -110.5kJ
CO(s) + ½O2(g) → CO2(g), ∆H3 = -283.0kJ
C(s) + O2(g) → CO2(g), ∆H1 = -393.5kJ
∴ ∆H1 = ∆H2 + ∆H3
'Chemistry' 카테고리의 다른 글
| 몰 농도 용액 제조 방법 (2) | 2021.11.11 |
|---|---|
| 퍼센트 농도 용액 제조 방법 (0) | 2021.11.08 |
| 중화 적정 표준 용액 표준화 방법 (0) | 2021.11.04 |
| 식초 속의 아세트산 함량 구하기 실험 (2) | 2021.11.04 |
| 고분자 물질의 합성 실험_플러버 (0) | 2021.11.01 |

