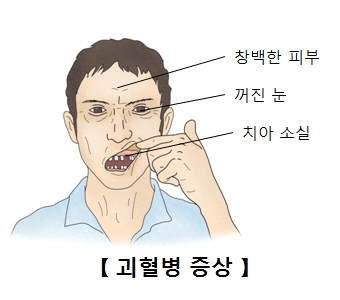
괴혈병은 비타민C인 아스코르브산 결핍증이다. 괴혈병에서 관찰되는 증상은 ‘전신 피로감, 하품, 호흡곤란, 두통, 메스꺼움, 병비, 우울증, 식욕감퇴, 잦은 혈관 출혈, 잇몸 출혈, 월경불순, 뼈나 관절 통증, 출혈, 창백증 빈혈, 뼈의 완화’ 등이다.
히포크라테스(Hippocrates)의 저서에고 괴혈병 기록이 있고 십자군 원정대, 신대륙 탐험대, 아프리카 희망봉을 돌아서 정가건 항해를 하던 선원들, 북미에서는 서부 개척자와 남북 전쟁 때, 흉년과 기근 시에 괴혈병 환자가 많았다고 한다. 최근에도 전쟁 및 분쟁 때문에 세워진 아프리카의 다섯 군데의 난민 수용소 인원의 상당수가 괴혈병에 시달렸고 산모 및 노인들이 특히 심하였다.

이런 괴혈병이 신선한 야채나 과일을 섭취함으로써 치료되며 예방된다는 것을 경험적으로 알게 되어 리백(Jan van Riebeeck)은 1652년, 남아프리카의 희망봉 근처에서 케이프 타운(Cape Town)이라는 도시를 건설하여, 희망봉을 돌아서 항해하던 동인도 회사(Dutch East India Company) 소속 선원들에게서 발생하였던 괴혈병을 치료해 주고 신선한 야채와 과일을 선박에 공급해 주었다고 한다.
또 블레인(Sir Gilbert Blane)은 1795년 영국 의회에서 영국 해군 병사에게는 하루 반 온스의 라임 주스(lime juice)를 의무적으로 공급할 것을 명하는 법률을 제정한 바 있으며, 영국 상선의 선원들도 규정을 지켜야 한다는 법률이 1844년 영국 의회를 통과하였다. 영국 해병의 별명이 Limey인 것은 매일 라인 주스를 먹지 않으면 안 된다는 이 규정에서 유래하였다. 이처럼 영국은 일찍이 괴혈병의 심각성을 인식하여 이를 예방하고 치료할 수 있었기에 막강한 해군력을 보유한 Pax Britancea 시대를 유지할 수 있었을 것이다.
이와 같이 괴혈병의 발병기 전이 명확히 밝혀지기 전에도 괴혈병의 원인, 치료 및 예방법의 원칙이 이미 확립되었다. 1932년이 되어서야 젠트교르기(Szent-Gyorgyi)에 의해 괴혈병을 예방하고 피료할 수 있는 물질은 비타민C라는 것이 밝혀졌고, 현재에는 구조와 특성, 작용기전까지도 밝혀졌다.
🧪 실험 목적
DCPIP(2,6-dichlorophenolindophenol) 적정방법을 이용하여 비타민 제품에 함유되어있는 비타민C의 양을 정량 분석한다.
🧪 실험이론
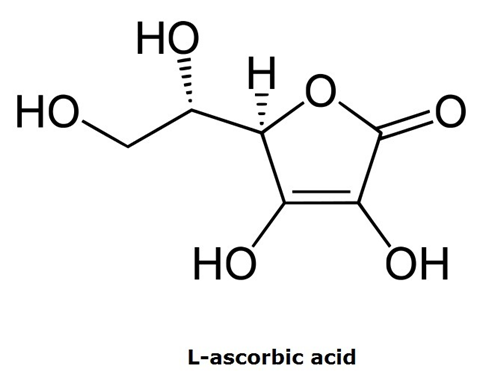
비타민C의 화학적 성격을 살펴보면 L-ascorbic acid는 dehydro-L-ascorbic acid로 쉽게 산화된다. 또 dehydro-L-ascorbic acid는 2,3-diketo-L-gulonic acid로 산화된다.
L-Ascorbic acid와 dehydro-L-ascorbic acid 사이의 변환은 가역적 산화, 환원 반응이지만 dehydro-L-ascorbic acid이 2,3-diketo-L-gulonic acid로 산화되는 것은 비가역 반응이다. 즉 비타민C는 dehydroascorbic acid로 산화되면서 다른 물질을 환원시키는 환원제로서 작용할 수 있는 물질이다.
비타민C는 동물의 콜라겐 (collagen)을 합성하는 데 필수적이다. 비타민C가 부족하면 콜라겐 합성과정이 차단되어 괴혈병의 전형적인 증상인 출혈, 감염 및 뼈의 연화 등의 증상이 나타난다. (콜라겐은 혈액 응고에 관여하는 물질이다.)
콜라겐을 합성하는 효소는 2가 상태의 철분 (Fe2+)과 느슨하게 결합하고 있어야 활성형 효소로 작용하며, 철분이 산화되어 3가 상태 (Fe3+)로 변하면 활성이 없어진다. 아스코르브산은 3가 상태 (Fe3+)의 철분을 2가 상태 (Fe2+)로 환원시켜 주며, 효소의 성분인-SH기를 환원 상태로 유지시켜주는 기능이 있기 때문에 콜라겐 합성을 도와주는 조효소 (coenzyme) 구실을 한다.
이와 같이 비타민C가 강력한 환원력을 지닌 물질이기 때문에 콜라겐 합성을 도와줄 수 있으며, 필요할 것이라는 것을 예상할 수 있을 것이다.
이 실험에서는 비타민C와 DCPIP의 산화 환원 반응을 이용하여 시중에 유통되고 있는 오렌지 주스 또는 드링크제의 비타민C의 함량을 확인해보도록 한다.


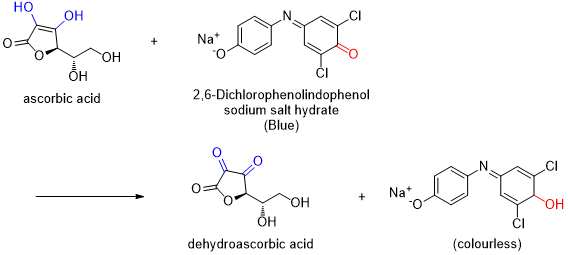
DCPIP (2,6-dichlorophenolindophenol)는 푸른색의 염료로써 환원된 상태에서는 무색이며 산화환원 반응을 할 수 있다. 비타민C는 좋은 환원제 이므로 DCPIP와 산화 환원 반응을 하여 당량점에서 색을 변화시킨다. 산성 조건에서 DCPIP는 분홍색을 띠고 다시 비타민C와 반응하여 무색이 된다. 적정하면서 비타민C가 모두 DCPIP와 반응하고 나면 용액은 다시 분홍색을 띤다.
DCPIP (blue) + H+ → DCPIPH (pink)
DCPIPH (pink) + VitC → DCPIPH2 (colourless)
C6H8O6 + C12H7NCl2O2 → C6H6O6 + C12H9NCl2O2
비타민C는 강력한 환원제이고, 비타민C와 1 : 1로 반응하는 DCPIP(2,6-dichlorophenolindophenol)를 이용하면 농도를 알고 있는 지시약 (DCPIP)의 산화, 환원 적정을 통해서 시료 속 비타민C의 함량을 계산할 수 있다.
🧪 실험 기구 및 시약
부피 플라스크, 삼각플라스크, 뷰렛, 피펫, 비타민C(Ascorbic acid;아스코르브산), 비타민C가 함유된 시료
2,6-dichlorophenolindophenol(DCPIP;C12H7NCl2O2)
🧪 실험 과정

1. 아스코르브산 표준용액으로 색소 표준용액의 적정
① 뷰렛을 아스코브르산 표준용액으로 채운다.
② 색소(DCPIP) 5 ml를 정확히 측정하여 삼각플라스크에 넣는다.
③ 용액의 색이 푸른색에서 투명하게 변하면 실험이 완료된다.
④ 실험 간 오차를 줄이기 위해 실험을 3 회 반복한다.
2. 제품에 들어있는 비타민C 정량분석
① 고체 시료는 증류수에 녹인다. (액체 시료는 바로 사용)
② 뷰렛을 시료로 채운다.
③ 색소(DCPIP) 5 ml를 정확히 측정하여 삼각플라스크에 넣는다.
④ 용액 색이 푸른색에서 투명하게 변하면 실험이 완료된다.
⑤ 실험 간 오차를 줄이기 위해 위에 실험을 3 회 반복한다.


🧪 실험 결과
▸ 아스코브르산 표준용액으로 색소 표준용액의 적정
| 0.01 M Vit C 적정량 (mL) | |
| 1회 | 6.3 |
| 2회 | 6.4 |
| 3회 | 6.4 |
| 평균 | 6.37 |
※ DCPIP 부피 10 mL
✔ DCPIP의 실제 농도
MDCPIP × VDCPIP = MVitC × VVitC
MDCPIP ×10 mL = 0.01 MVitC × 6.37 mLVitC
MDCPIP = 6.37×10-3 MDCPIP
✔ 제품 속 비타민C 정량분석

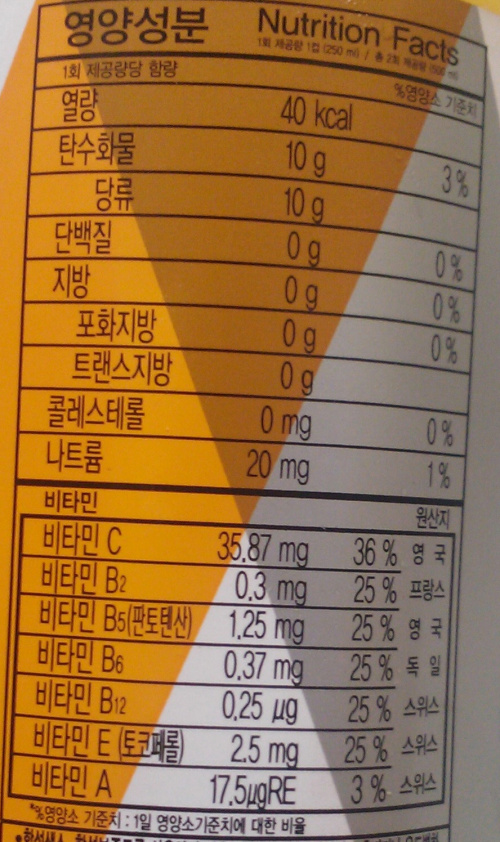

| 시료명 | 영양성분표 상 비타민C 함량 |
| A. *** | 500 mg / 100 mL |
| B. *** | 35.87 mg / 100 mL |
| C. *** | 130 mg / 210 mL |
✔ 시료 속 비타민C 농도 계산
| 시료명 | DCPIP 양 | 시료 적정량 | ||
| 1 회 | 2 회 | 평균 | ||
| A. *** | 10 ml | 2.2 ml | 1.7 ml | 1.95 ml |
| B. *** | 1 ml | 3.5 ml | 3.3 ml | 3.4 ml |
| C. *** | 10 ml | 19.1 ml | 15.8 ml | 17.5 ml |
🧃 A 시료
MDCPIP × VDCPIP = MA × VA
6.37×10-3 MDCPIP ×10 mL = MA × 1.95 mLA
MA = 3.27×10-2 M
A = 3.27×10-2 M × 176.13 g/molVitC = 5.759 g/L = 572.9 mg/100 mL
🧃 B 시료
MDCPIP × VDCPIP = MB × VB
6.37×10-3 MDCPIP ×1 mL = MB × 3.4 mLB
MB = 1.87×10-3 M
B = 1.87×10-3 M × 176.13 g/molVitC = 0.329 g/L = 32.9 mg/100 mL
🧃 C 시료
MDCPIP × VDCPIP = MC × VC
6.37×10-3 MDCPIP<s/ub> ×10 mL = MC × 17.5 mLC
MC = 3.64×10-3 M
C = 3.64×10-3 M × 176.13 g/molVitC = 0.641 g/L = 134.6 mg/210 mL
| 시료 | 영양성분표 | 실험 결과 | % 오차 |
| A.*** | 500 mg/100 mL | 572.9 mg | 14.58 % |
| B. *** | 35.87 mg/100 mL | 32.9 mg | 8.28 % |
| C. *** | 130 mg/210 mL | 134.6 mg | 3.53 % |
'Chemistry' 카테고리의 다른 글
| 화학 반응 양적 관계 실험 (0) | 2021.10.25 |
|---|---|
| 우유 속 칼슘 정량 분석 실험 (0) | 2021.10.21 |
| 수질검사 실험 (18) | 2021.10.19 |
| 물의 경도 측정 실험 (0) | 2021.10.18 |
| 수돗물 속 염화 이온의 정량 분석 실험 (0) | 2021.10.14 |



