🧪 실험 목표
화학 전지를 구성해 기전력을 측정하고, 전해질의 농도와 전지 전위와의 관계를 알아본다.
🧪 실험 원리
✏️ 반쪽전지
반쪽 전지(Half-cell)는 금속과 금속 이온이 포함된 수용액으로 구성되어 있으며, 반쪽 전지에서 표준 상태란 수용액 속 금속 이온의 농도가 1.0 M일 때를 의미한다. 예를 들어 순수한 Zn 금속과 1.0 M Zn2+(aq) 수용액은 표준 Zn | Zn2+ 반쪽 전지를 구성한다. 반쪽 전지에서 금속은 전극(electrode)이라고 한다.

✏️ 화학 전지
화학 전지는 두 개의 반쪽 전지가 도선과 염다리로 연결되며 형성된다. 두 전극을 도선으로 연결하면 자발적인 산화·환원 반응에 의해 산화가 일어나는 산화 전극(anode)에서 환원이 일어나는 환원 전극(cathode)으로 전자가 이동하며 전류가 흐른다. 이때 전지의 성능은 전위차에 의존한다. 화학 전지는 (-)극 금속의 산화 반응성이 커서 전자를 쉽게 내놓을수록, (+)극 금속 양이온의 환원 반응성이 커서 전자와 잘 결합할수록 전하의 불균형이 커지며 큰 전압과 전류를 발생한다. 이때 전해질 수용액 중 한 쪽은 양이온이 감소하고 다른 쪽은 증가하며 생기는 전하의 불균형은 염다리(salt bridge)를 설치해 해결할 수 있다.

✏️ 표준 환원 전위
표준 환원 전위(standard reduction potential, E°)는 표준 상태에서 표준 수소 전극을 기준으로 각 반쪽 전지에서 금속의 환원 반응의 전위를 측정한 값이다. 이 값이 양으로 클수록 환원이 잘 일어나고, 이 값이 음으로 클수록 산화가 잘 일어난다. 표준 환원 전위가 클수록 화학 전지의 (+)극이 되기 쉽고, 작을수록 (-)극이 되기 쉽다. 표준 상태에서 전지의 전위(표준 전지 전위, E°cell)는 다음과 같이 계산한다.

✏️ 네른스트 식
표준 전지 전위와 표준 깁스 자유 에너지는 다음과 같은 관계를 가진다.

전지 반응에 참여하는 화합물이 표준 상태에 있지 않을 때는 다음과 같은 관계를 가진다.
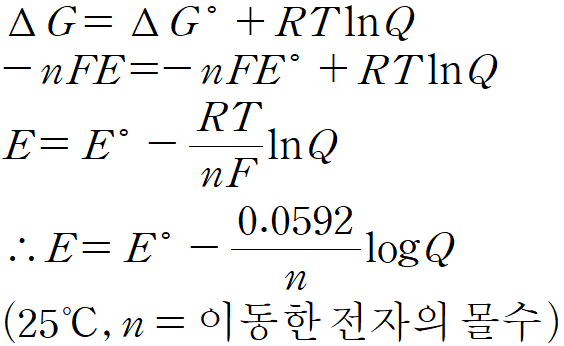
이처럼 전지의 전압과 농도 사이의 관계를 나타내는 식을 네른스트 식(Nernst Equation)이라 하며, 이를 이용해 표준 조건이 아닌 상태에서의 전지 기전력을 알아낼 수 있다.

🧪 시약 및 기구
1.0 M 황산아연(ZnSO4, Zinc sulfate), 1.0 M 황산구리(CuSO4, Copper sulfate), 구리(Cu)판, 아연(Zn)판 각 4개, 사포, 멀티미터(또는 전압계) 1개, 시험관 8개, 시험관대, 100 mL 부피플라스크 4개, 염다리, 피펫
📌 유의 사항
1) 금속판은 크기가 같은 것으로 준비하고 사용하기 직전 사포로 갈아서 금속 표면의 산화막을 제거한다.
2) 금속염 수용액은 피부에 자극적일 수 있으니 피부에 닿으면 깨끗한 물로 충분히 씻는다.
🧪 실험 방법
💡 전지의 기전력 측정
1. 시험관 2개를 준비하여 1.0 M CuSO4, 1.0 M ZnSO4 수용액을 각각 담는다.
2. CuSO4 수용액에는 Cu판을, ZnSO4 수용액에는 Zn판을 꽂는다.
3. 서로 다른 금속이 담긴 시험관 두개를 염다리로 연결한다.
4. 각 반쪽전지를 멀티미터에 연결하여 전압(기전력)을 측정한다.


💡 전해질 농도와 전지 전위와의 관계
1. 피펫을 이용해 1.0 M CuSO4 수용액 10 mL를 정확히 취해 100 mL 부피플라스크에 넣고 증류수를 눈금까지 채워 0.1 M CuSO4 수용액을 만든다.
2. 피펫을 이용해 0.1 M CuSO4 수용액 10 mL를 정확히 취해 100 mL 부피플라스크에 넣고 증류수를 눈금까지 채워 0.01 M CuSO4 수용액을 만든다.
3. 피펫을 이용해 0.01 M CuSO4 수용액 10 mL를 정확히 취해 100 mL 부피플라스크에 넣고 증류수를 눈금까지 채워 0.001 M CuSO4 수용액을 만든다.
4. 위에서 만든 CuSO4 수용액을 각각 시험관에 담고, Cu판을 꽂는다.
5. 1.0 M ZnSO4 용액을 3개의 시험관에 담고, Zn 판을 꽂는다.
6. 서로 다른 금속이 담긴 두 시험관을 염다리로 연결한 후, 멀티미터로 전압을 측정한다.


🧪 결과 및 분석
✔️ 전지의 기전력 측정
❓ 표준 환원 전위를 이용해 전지의 기전력을 계산하고, 실험에서 측정한 값과 비교한다.
표준 기전력 = 0.34-(-0.76) = 1.10 V
측정 기전력 = 1.09 V
❓표준 환원 전위를 참고한 전지의 기전력과 측정한 값이 다른 이유는 무엇인가?
표준 환원 전위는 25 ℃로 측정된 값으로 위 실험에서 온도의 영향을 배재하였다.
금속판의 면적이 다르거나, 금속판 산화막으로 인해 전압이 떨어 졌을 것이다.
✔️ 전해질 농도와 전위와의 관계
❓실험에서 얻은 값을 다음 표에 정리한다.
| [Cu2+(aq)] (M) | log[Cu2+(aq)] | Ecell(vs Zn l Zn2+ (1.0 M)) (V) |
| 1.0 | 0 | 1.076 |
| 0.1 | -1 | 1.075 |
| 0.01 | -2 | 1.064 |
| 0.001 | -3 | 1.056 |
❓전해질 농도와 전지 전위와의 관계를 분석하면?
구리 이온(Cu2+)의 농도가 1/10로 감소해도 전지의 전위는 크게 감소하지 않았다. 이는 구리(Cu)와 아연(Zn)의 전위차는 일정해 동일한 전압을 발생한다고 볼 수 있다. 다만, 농도가 낮으면 반응할 수 있는 양이 적어 전지의 용량이 줄어들 것이다.
** 염다리 만드는 방법
1. 비커에 따뜻한 물 60 mL를 담고 질산칼륨(KNO3) 약 15g을 녹인다.
2. 질산 칼륨이 다 녹으면 한천가루 약 5 g을 넣어 천천히 저어준다.
3. 식으며 점성이 생긴 용액을 주사기에 담고 비닐관에 천천히 넣어준다.
4. 비닐관 중간에 기포가 생기지 않도록 하고, 비닐관에서 약간 굳힌 뒤 사용한다.



'Chemistry' 카테고리의 다른 글
| 간단한 아스피린 합성 실험 (2) | 2023.09.25 |
|---|---|
| 윌슨의 안개상자 실험(with 방사선 관찰) (0) | 2023.05.23 |
| 식용유를 이용한 바이오 디젤 합성 실험 (0) | 2023.04.11 |
| 아스코르브산 함량 측정(with 아이오딘 적정법) (0) | 2022.10.13 |
| 음료 속 카페인 추출 및 확인 (0) | 2022.10.13 |



