🧪 실험 목표
아이오딘산 칼륨 수용액(KIO3(aq))의 농도에 따른 반응속도의 변화를 측정하여 농도와 반응 속도의 관계를 설명할 수 있다.
🧪 실험 이론
[아이오딘 시계반응의 반응 단계]
아이오딘산 칼륨(KIO3) 수용액 + 아황산수소 나트륨(NaHSO3) 수용액의 반응
① IO3- + 3HSO3- → I- + SO42- + 3H+
② IO3- + 8I- → 3I3- + 3H2O
③ I3- + HSO3- + H2O → 3I- + SO42- + 3H+
④ 2I- + 녹말 → 녹말-I5-(청람색) + I-
이 반응은 IO3-이 HSO3-에 의해 환원되어 I-이 되고, I-에 의해 생성된 I3-이 녹말 분자사이에서 청람색의 착물을 형성하는 반응이다. 이 반응은 ① ~ ③ 단계까지 연속적으로 거의 동시에 일어나는 속도가 빠른 반응이다. 농도에 따라 반응점을 조절할 수 있어 농도를 달리하여 반응 시간을 조절하는 예로, 흔히 시계반응이라고 한다.
일반적으로, ①에서 보는 것처럼 NaHSO3(aq)의 반응 몰수는 화학양론적으로 KIO3(aq)의 3배이다. 만일 NaHSO3(aq)이 3배이상인 경우에는 ① ~ ③ 까지의 반응이 진행된다. NaHSO3(aq)이 모두 소모되어 더이상 ③이 일어나지 못하게 되면 ④이 일어나며, 용액의 색이 변하게 된다.
[화학평형과 반응속도]
화학 평형 상태는 정반응 속도와 역반응 속도가 같아져서 더 이상 반응이 일어나지 않는 것처럼 보이는 상태이다. 가역 반응에서 반응 용기에 반응물만 넣어 주면 반응물의 양은 점점 감소하므로 정반응 속도는 점점 느려지고, 생성물의 양은 점점 증가하므로 역반응 속도는 점점 빨라진다. 시간이 지나 정반응 속도와 역반응 속도가 같아지면 화학 평형상태가 된다.

🧪 준비물
아이오딘산칼륨(KIO3)용액, 아황산수소나트륨(NaHSO3)용액, 녹말, 증류수, 시험관 5개, 시험관대, Y자 시험관 3개, 눈금피펫, 홀 피펫, 피펫필러, 1L 비커 3개, 얼음, 전기포트, 초시계, 눈금실린더 5개, 장갑, 보안경
🧪 실험방법
1. 5개의 시험관에 각각 녹말을 섞은 0.02M 아이오딘산칼륨(KIO3) 용액을 10 mL씩 넣는다.(0.02 M 아이오딘산칼륨(KIO3)용액 100 mL에 녹말은 작은 수저로 한 수저 정도 넣어서 준비한다.)
2. 0.05 M 아황산수소나트륨(NaHSO3)용액 2 mL를 눈금실린더에 넣고 여기에 전체 부피가 10mL가 되도록 증류수를 넣어 희석시킨다.
3. 같은 방법으로 아황산수소나트륨(NaHSO3)용액 4 mL, 6 mL, 8 mL, 10 mL를 각각 눈금 실린더에 넣고 여기에 전체 부피가 10 mL가 되도록 증류수를 넣어 희석시킨다.
4. 0.02 M 아이오딘산칼륨(KIO3)용액 10 mL가 담긴 시험관에 첫 번째 희석시킨 아황산수소나트륨(NaHSO3)용액을 넣는 순간부터 초시계를 작동시켜 청자색이 나타나는 순간까지의 시간을 기록한다.
5. 2~5 시험관도 위와 같이 반응시켜 시간을 기록한다.
📌 실험에서 변화시켜야 하는 요인(조작변인)과 일정하게 유지해야 하는 조건(통제변인)은 무엇인가?
조작변인 : 용액의 농도, 통제변인 : 온도, 용액의 부피
🧪 실험결과 및 분석
📌 실험 데이터를 기록하고 반응속도를 구하시오.
| 시험관 | 0.05 M NaSO3 (mL) | 증류수 (mL) |
NaHSO3 몰농도 (M) |
KIO3 몰농도 (M) |
반응 시간 (s) |
반응 속도 (s-1) |
| 1 | 2 | 8 | 0.01 | 0.02 | 153.05 | 0.0065 |
| 2 | 4 | 6 | 0.02 | 0.02 | 59.98 | 0.0167 |
| 3 | 6 | 4 | 0.03 | 0.02 | 35.23 | 0.0284 |
| 4 | 8 | 2 | 0.04 | 0.02 | 24.45 | 0.0409 |
| 5 | 10 | 0 | 0.05 | 0.02 | 24.79 | 0.0403 |
📌 가로축을 아황산나트륨(NaHSO3) 수용액의 농도, 세로축을 반응시간(s)과 반응속도(s-1)로 그래프로 그리시오.


📌 실험 결과를 토대로 농도에 의해 반응속도는 어떻게 변한다고 결론지을 수 있는가?
농도가 증가할수록 반응속도는 빨라진다.
📚 왜?
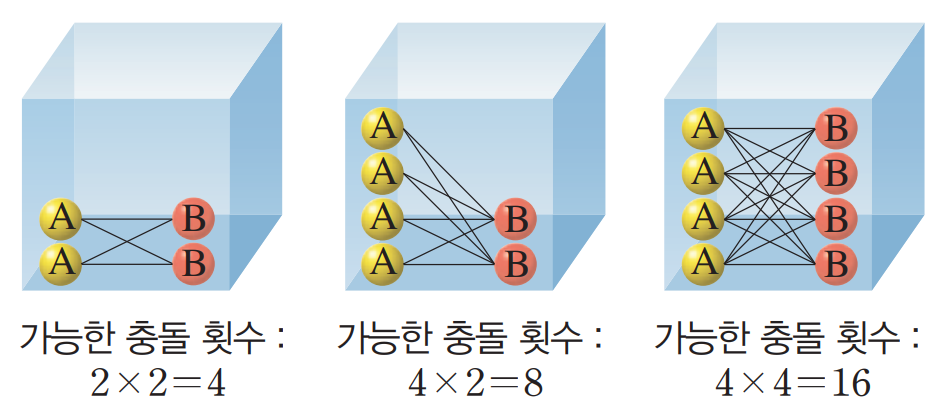
반응물 A와 B가 반응할 때 반응물 B의 농도가 증가하면 단위 부피 속의 입자 수가 많아지므로 입자 사이의 거리가 가까워진다. 따라서 입자가 같은 속도로 움직인다면 입자들이 충돌하는데 걸리는 시간이 짧아져 입자 한 개가 단위시간당 충돌하는 횟수가 많아진다. 입자들의 충돌 횟수가 많아지면 같은 시간 동안에 반응하는 입자 수가 많아지므로 반응 속도가 빨라진다.
'Chemistry' 카테고리의 다른 글
| 아스코르브산 함량 측정(with 아이오딘 적정법) (0) | 2022.10.13 |
|---|---|
| 음료 속 카페인 추출 및 확인 (0) | 2022.10.13 |
| 온도에 따른 화학 반응 속도 측정 실험 (0) | 2022.05.31 |
| 온도 변화에 따른 화학 평형 이동 실험 (0) | 2022.05.10 |
| 에탄올의 분자량 측정 실험 (0) | 2021.12.06 |



