🧪 실험 목표
온도 변화에 따른 평형 이동을 설명할 수 있다.
🧪 실험 이론
어떤 반응이 평형 상태에 있을 때, 온도를 높이면 반응은 온도가 낮아지려는 쪽인 흡열반응으로 진행되고, 온도를 낮추면 반응은 온도가 높아지려는 쪽인 발열 반응 쪽으로 진행된다. 열을 화학 반응물로 간주하면 쉽게 이해할 수 있다. 반응계에 열을 ‘첨가’하면, 온도가 올라가고, 열을 ‘제거’하면 온도는 떨어진다. 다른요인(농도, 압력, 부피)의 변화에서 같이 반응계는 변화의 영향을 줄이기 위해 이동한다. 그러므로, 온도의 증가는 흡열반응으로 진행하고, 온도의 감소는 발열 반응으로 진행하게 된다.
흡열 반응 : 반응물 + 열 ⇄ 생성물
발열 반응 : 반응물 ⇄ 생성물 + 열
| 구분 | 정반응이 발열반응인 경우 | 정반응이 흡열 반응인 경우 | ||
| 온도 증가 | 온도 감소 | 온도 증가 | 온도 감소 | |
| 반응 방향 | 역반응 | 정반응 | 정반응 | 역반응 |
| 평형 상수 | 감소 | 증가 | 증가 | 감소 |
| 반응 속도 | 증가 | 감소 | 증가 | 감소 |
| 결과 | 생성물 감소 | 생성물 증가 | 생성물 증가 | 생성물 감소 |
🧪 준비물
황산구리(Ⅱ)(CuSO4), 진한 염산, 증류수, 얼음, 시험관, 비커, 스포이트, 시험관대, 보안경, 실험용 장갑
📌 황산구리(Ⅱ)(CuSO4) 수용액과 진한 염산(HCl)은 다음과 같이 평형을 이룬다.
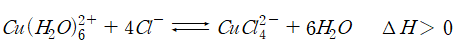
※ 실험에서 온도에 따라 용액의 색이 어떻게 변할지 예상하고 그 까닭을 쓰시오.
· 온도를 높이면?
[ 흡열 반응이므로 온도를 높이면 정반응 쪽으로 평형이 이동해 CuCl42-의 농도가 증가하고 용액은 노란색이 된다. ]
· 온도를 낮추면?
[ 흡열 반응이므로 온도를 낮추면 역반응 쪽으로 평형이 이동해 Cu(H2O)62+ 농도가 증가하고 용액은 푸른색이 된다. ]
🧪 실험 방법
1. 시험관 A, B에 0.5 M 황산구리(Ⅱ) 수용액을 5 mL씩 넣는다.
2. 시험관 A, B에 진한 염산을 3 mL씩 넣고 섞는다.
3. 시험관 A를 얼음물에 넣고 색 변화를 관찰한다.
4. 시험관 B를 뜨거운 물에 넣고 색 변화를 관찰한다.



🧪 실험 결과
※ 용액의 색을 기록한다.
| 용액 | 황산구리(Ⅱ) 수용액 | 진한 염산을 넣었을 때 | 얼음물에 넣었을 때 | 뜨거운 물에 넣었을 때 |
| 용액의 색 | 푸른색 | 청록색 | 푸른색 | 진한녹색 |
※ 평형은 각각 어느쪽으로 이동하는가?
[ 얼음물에 넣었을 때, 흡열 반응에서 열을 감소시켰으므로 열을 증가시키는 방향인 역반응 쪽으로 평형이 이동한다. ]
[ 뜨거운물에 넣었을 때, 흡열 반응에서 온도를 높이면 온도를 낮추기 위해 열을 흡수하는 정반응 쪽으로 평형이 이동한다. ]
※ 실제 실험결과가 예상한 결과와 다른 이유?
[ 황산구리 수용액은 푸른색이지만 염산을 가했을 때 청록색으로 변한 상태에서 실험을 진행하였고, 뜨거운 물에 넣었을 때 평형에서 노란색인 CuCl42-의 농도가 상대적으로 커서 청록색보다 진한 녹색이 되었다.]
'Chemistry' 카테고리의 다른 글
| 농도에 따른 화학 반응 속도 측정 실험 (0) | 2022.05.31 |
|---|---|
| 온도에 따른 화학 반응 속도 측정 실험 (0) | 2022.05.31 |
| 에탄올의 분자량 측정 실험 (0) | 2021.12.06 |
| 몰랄 농도 용액의 제조 (0) | 2021.11.29 |
| 화학반응에서 열의 출입 측정하기_실험편 (0) | 2021.11.26 |


